Ősi nyomok a fehérjékben
Nem hagyható figyelmen kívül, hogy az Illinois-i Egyetem kutatói több mint 4,3 milliárd dipeptidszekvenciát elemeztek, amelyek 1 561 különböző élőlény teljes fehérjekészletéből származnak, lefedve az élet három szuperkirályságát: Archeák, Baktériumok és Eukarióták. A dipeptidek két aminosavból álló alapmodulok, és 400 lehetséges kombinációjuk különböző gyakorisággal fordul elő a különböző organizmusokban. A nagy adathalmaz elemzése során egy filogenetikai törzsfát készítettek, amely feltárja, miként fejlődtek ezek az alapvető fehérjetípusok az idők során. Egy másik vizsgálatban ezeket a dipeptideket fehérjestruktúra-domének filogenetikai fájára vetítették, és arra voltak kíváncsiak, hogy hasonló minták fedezhetők-e fel.
A genetikai kód eredete: kettős nyelv
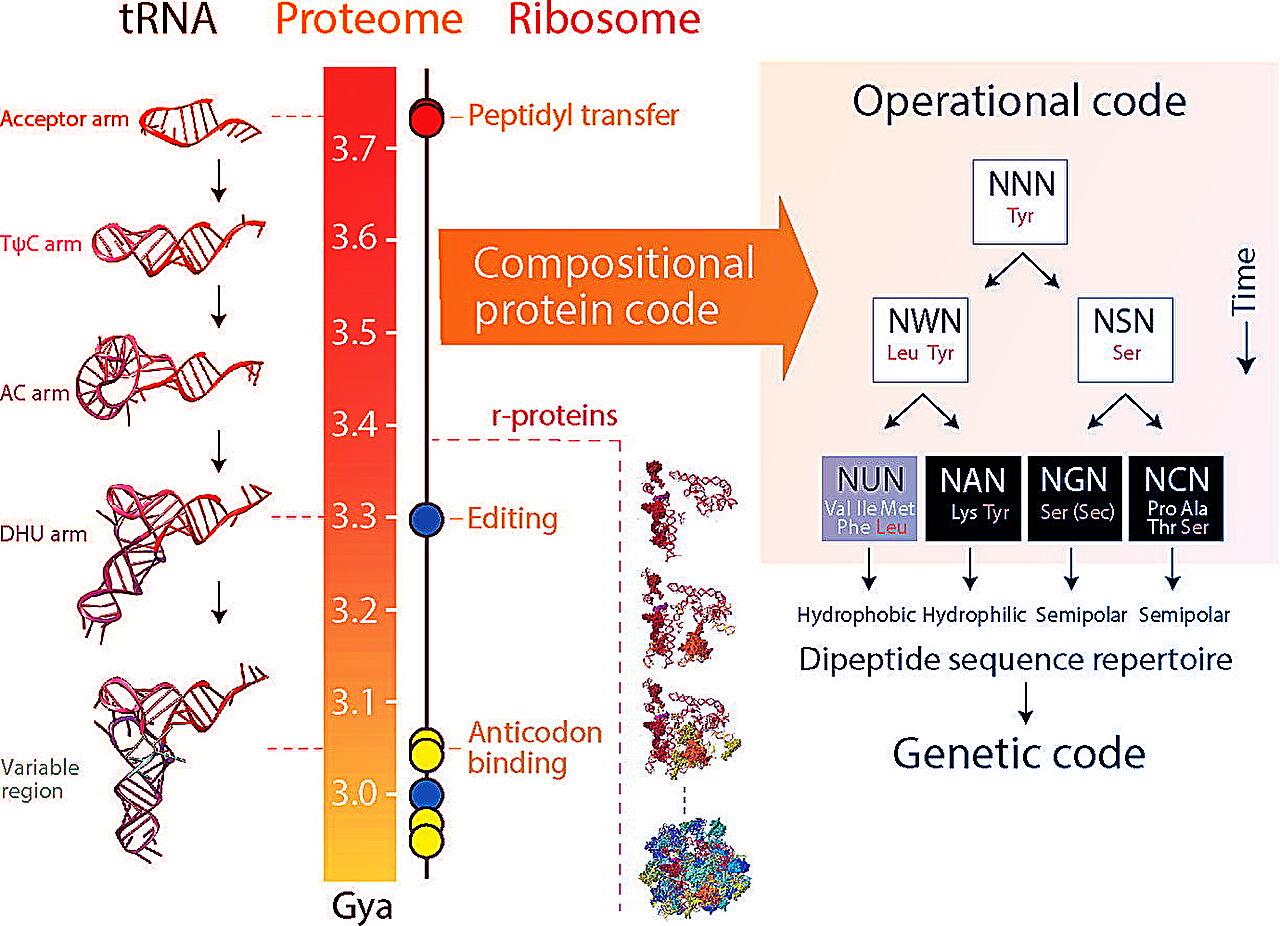
Bár a legtöbb elmélet szerint az élet hajnalán először RNS-alapú enzimek működtek, más kutatók inkább úgy vélik, hogy fehérjék hozták létre az első bonyolult rendszereket. Gustavo Caetano-Anollés csoportja ez utóbbi elképzelést támasztja alá. Szerintük először a fehérje „nyelv” jelent meg, majd tRNS-molekulák és szintetáz enzimek segítségével kapcsolódott az örökítőanyag „nyelvéhez”. A két rendszer között a riboszóma teremt hidat: itt állnak össze a sejtek fehérjéi, a tRNS-ek az egyes aminosavakat hozzák a megfelelő helyre, a szintetáz enzimek pedig ellenőrzik, hogy minden pontosan történik.
Kiderült, hogy az ősi fehérje „szókészletet” jelentős részben dipeptidek alkották. Ezek mint ősi strukturális építőkövek már a legkorábbi fehérjékben is jelen lehettek, és így a genetikai kód formálásában is kulcsszerepet játszhattak.
Az aminosavak evolúciós sorrendje
A kutatás szerint az aminosavak megjelenése időrendbe állítható. A legrégibbek: a tirozin, szerin és leucin, mellettük nyolc további aminosavval (összesen 11) képezték az első két hullámot. Felismerték, hogy már az ősi szintetáz enzimekhez is kapcsolódott hibajavítás, vagyis képesek voltak kijavítani a rosszul beépülő aminosavakat. A harmadik csoport aminosavai csak később jelentek meg, és főként a genetikai kód szabványosításához köthetők.
Érdekes fejlemény volt, amikor a dipeptid és anti-dipeptid párokat (például alanin-leucin és leucin-alanin) vizsgálták: szinte szinkronban, párosával jelentek meg az evolúció során, mintha egymás tükörképei lennének. Ez arra utalhat, hogy a genetikai kód kétirányú olvashatósága már korán megjelent, és minimális tRNS-szerű molekulák, illetve primitív szintetáz enzimek működtek közre.
Ősi fehérjekód, modern következmények
A kutatók szerint a dipeptidek nem véletlenszerűen társultak, hanem alapvető strukturális elemekként meghatározták, hogyan hajlottak meg és működtek a fehérjék. Ez egy ősi fehérjekódra utal, amely a fehérjestruktúrák sajátos igényeihez igazodva fejlődött ki. Emellett az akkor létező RNS-alapú operatív kód is közrejátszhatott: ezek együtt hozták létre azt, amit ma „néma örökítőnyelvként” (silent genetic code) emlegetnek.
A fentiek tükrében a genetikai kód eredetének feltárása nemcsak az élet alapjainak jobb megértését segíti, hanem modern területekre is hatással van, mint a genetikai mérnökség, a bioinformatika vagy a mesterséges biológia. Fontos kiemelni, hogy az evolúciós megközelítés révén a szintetikus biológia is hatékonyabb tervezéshez jut: ha ismerjük a kódok logikáját és az ősi rendszerek ellenálló, változatlan természetét, jobban tudunk beavatkozni és javítani.
Végső soron az élet kettős nyelvének feltárása nemcsak tudományos bravúr, hanem a jövő biotechnológiájának is kulcsfontosságú eszköze lehet.