Az asztrociták rejtett kapcsolói
Miközben a legtöbben a géneket az egészség, a személyiség és az öröklődés első számú mozgatórugóiként képzeljük el, a valóságban ez csupán az emberi DNS kisebbik – mintegy 2 százalékos – szeletét jelenti. A fennmaradó 98 százalék évtizedeken át „nem kódoló genommá”, azaz szemét DNS-sé minősült, noha valójában ez szabályozza, mikor, mely gének lépnek működésbe, és milyen intenzitással.
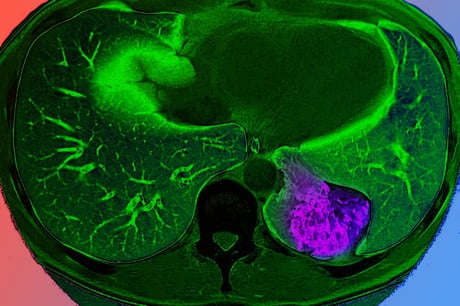
Jelentőséggel bír, hogy a friss, a Nature Neuroscience-ben közölt vizsgálat több mint 1000 potenciális génkapcsolót (úgynevezett enhanszert) tesztelt humán asztrocitákban, laboratóriumi körülmények között. Ezek a kapcsolók a génektől akár több százezer bázispár távolságra is elhelyezkedhetnek, ezért nehezen kutathatók.
Innovatív módszerek az enhanszerek feltérképezésére
A kutatók a CRISPRi technológiát kombinálták egysejtes RNS-szekvenálással. Az eljárás lehetővé tette, hogy szelektíven kapcsolják le a vizsgált enhanszereket, miközben a sejt szintjén követték a génkifejeződés változását. Az eredmény: a közel 1000 vizsgált enhanszerből mintegy 150 bizonyult valódi „főkapcsolónak” – ezek jelentős része közvetlen hatással van olyan gének működésére, amelyeket már összefüggésbe hoztak az Alzheimer-kórral.
A lehetséges „bűnösök” listájának ilyen mértékű szűkítése az Alzheimer-kutatások új korszakát nyithatja meg, hiszen eddig az esetek többségében nem a génen belüli, hanem a köztes („in-between”) DNS-szakaszokban fordultak elő a betegségek hátterében rejlő mutációk.
A legérdekesebb rész még csak ezután jön
Ami pedig – és ez az igazi áttörés – most következik: ezt a rengeteg adatot MI-algoritmusokkal elemzik, hogy pontosabban előrejelezzék, mely enhanszerek szabályozók, és melyek csak zajt jelentenek a genomban. Az adattömeg már a DeepMind AlphaGenome nevű modelljének fejlesztését is segíti. Vagyis már nem kell évekig laborban egyenként vizsgálni a kapcsolókat: a betanított MI-rendszerek tovább gyorsítják a felfedezést.
Pontosság és célzott terápia a láthatáron
Az, hogy az enhanszerek csak bizonyos sejttípusokban – például asztrocitákban – aktívak, egyben lehetőséget is teremt: célzottan, precíziós módszerekkel befolyásolhatók akár génterápiás megközelítéssel is, miközben a neuronokat érintetlenül hagyják. Bár mindez még a klinikai alkalmazástól messze jár, a vérképzőszervi betegségek gyógyításában már hasonló, sejttípus-specifikus enhanszerre épülő génszerkesztő terápiát vezettek be.
Az Alzheimer-kutatás tehát új térképet kapott: immár tudjuk, hol keressük azokat a kapcsolókat, amelyek szinte láthatatlanul, de döntő módon határozzák meg egyes agyi gének sorsát – és közvetve az egészségünket is.