Apró pórusok, nagy veszteség
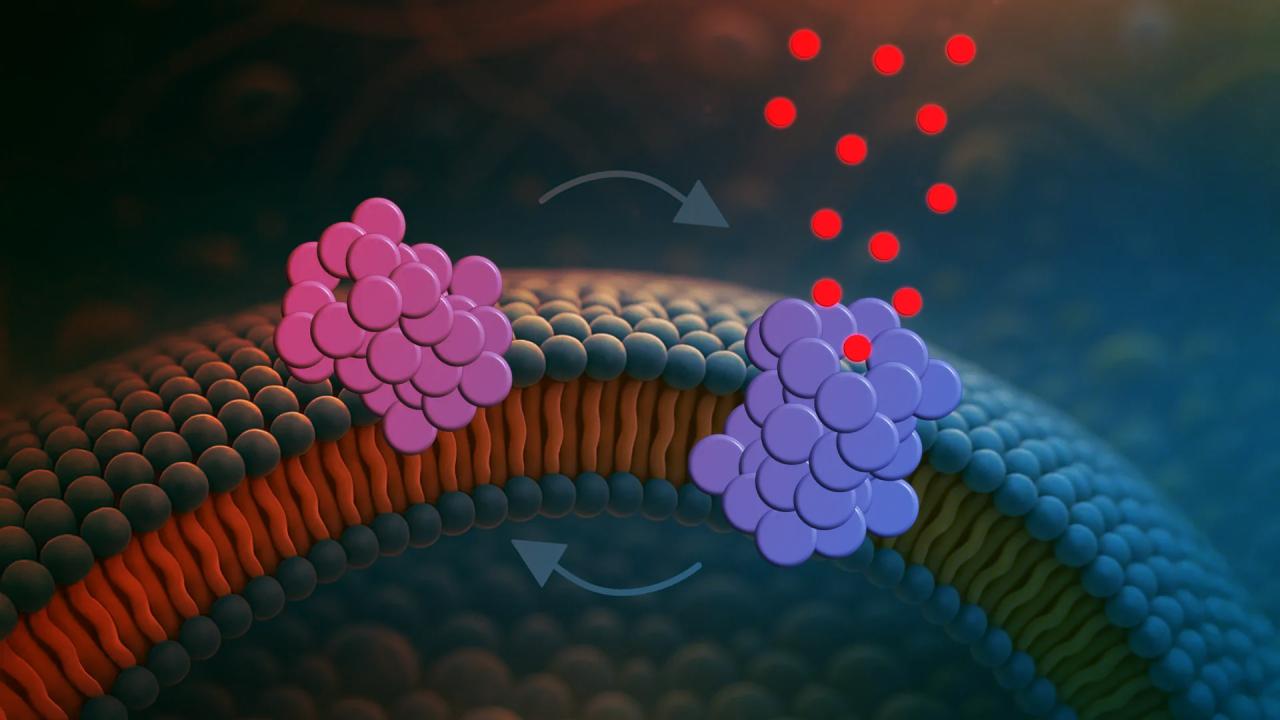
Az egészséges agyban az alfa-szinuklein a sejtek közötti kommunikációban játszik szerepet, Parkinson-kór esetén viszont kórosan elkezd összecsapzódni. Bár eddig főleg a nagyobb, jól észlelhető fibrillumokról szóltak a kutatások, most a kisebb, sokkal toxikusabb oligomereket figyelték meg. Ezek az oligomerek dinamikusan viselkednek: először a membrán görbült régióira tapadnak, majd félig belefúródnak, és végül rövid időre apró pórusokat nyitnak, amelyeken át molekulák szökhetnek át. Ez a folyamat kicsit olyan, mint az apró forgóajtók: a pórusok nem tartósak, hanem folyamatosan nyílnak és záródnak, így érthető, hogy az idegsejtek nem pusztulnak el azonnal.
Noha a pórusok csak néhány másodpercig maradnak nyitva, utána az oligomer visszaáll eredeti állapotába, majd ismét pórust képez – oda-vissza váltogatva ezt a két állapotot, újra és újra veszélyeztetve a sejt épségét. Ebből arra lehet következtetni, hogy a Parkinson-kór lassú, hullámzó előrehaladása is ebből a dinamikus folyamatból ered.
Lassított molekuláris mozi: közelebb a célponthoz
A kutatók egy speciális, egyetlen vezikulát elemző platformot fejlesztettek ki, amely lehetővé tette, hogy élőben, szinte filmként kövessék a molekuláris interakciókat. A vezikulák – amelyek mesterségesen előállított, sejthártyához hasonló kis buborékok – leegyszerűsítik a vizsgálatot, kizárva a zavaró tényezőket. Azt figyelték meg, hogy a pórusképződés főként ott megy végbe, ahol a membrán szerkezete a mitokondriumok, vagyis a sejtek energiaforrásainak membránjához hasonlít. Ez azt sugallja, hogy a károsodás talán éppen ezekben az “erőművekben” kezdődik.
A kutatócsoport nanorészecske-méretű antitestfragmensekkel is dolgozott, amelyek képesek az oligomerekhez kötődni. Bár ezek egyelőre nem tudták teljesen megállítani a pórusképződést, igen ígéretes diagnosztikai markereknek bizonyulhatnak, lehetővé téve a betegség jóval korábbi felismerését – ami kritikus jelentőségű, mivel a Parkinson-kórosokat általában csak komoly idegrendszeri károsodás után diagnosztizálják.
Tovább a sejtkísérletektől
Fontos kiemelni, hogy a vizsgálatok mesterséges modelleken folytak, élő agyszöveten csak a következő lépésben tudják majd reprodukálni az eredményeket. Az út a valódi kezelésig még hosszú, de a most kidolgozott platform nagyban segítheti az új gyógyszerek vagy diagnosztikai tesztek fejlesztését. Az áttöréshez további összehasonlításokra van szükség valós biológiai rendszerekben, ahol már az élő sejtek teljes bonyolultsága is közrejátszik.